Pollen viability of Peltodon longipes using distinct staining methods
DOI:
https://doi.org/10.70151/3z0eq320Keywords:
Peltodon longipes, pollen, acetic orcein, acetic carmine, Alexander’s stainAbstract
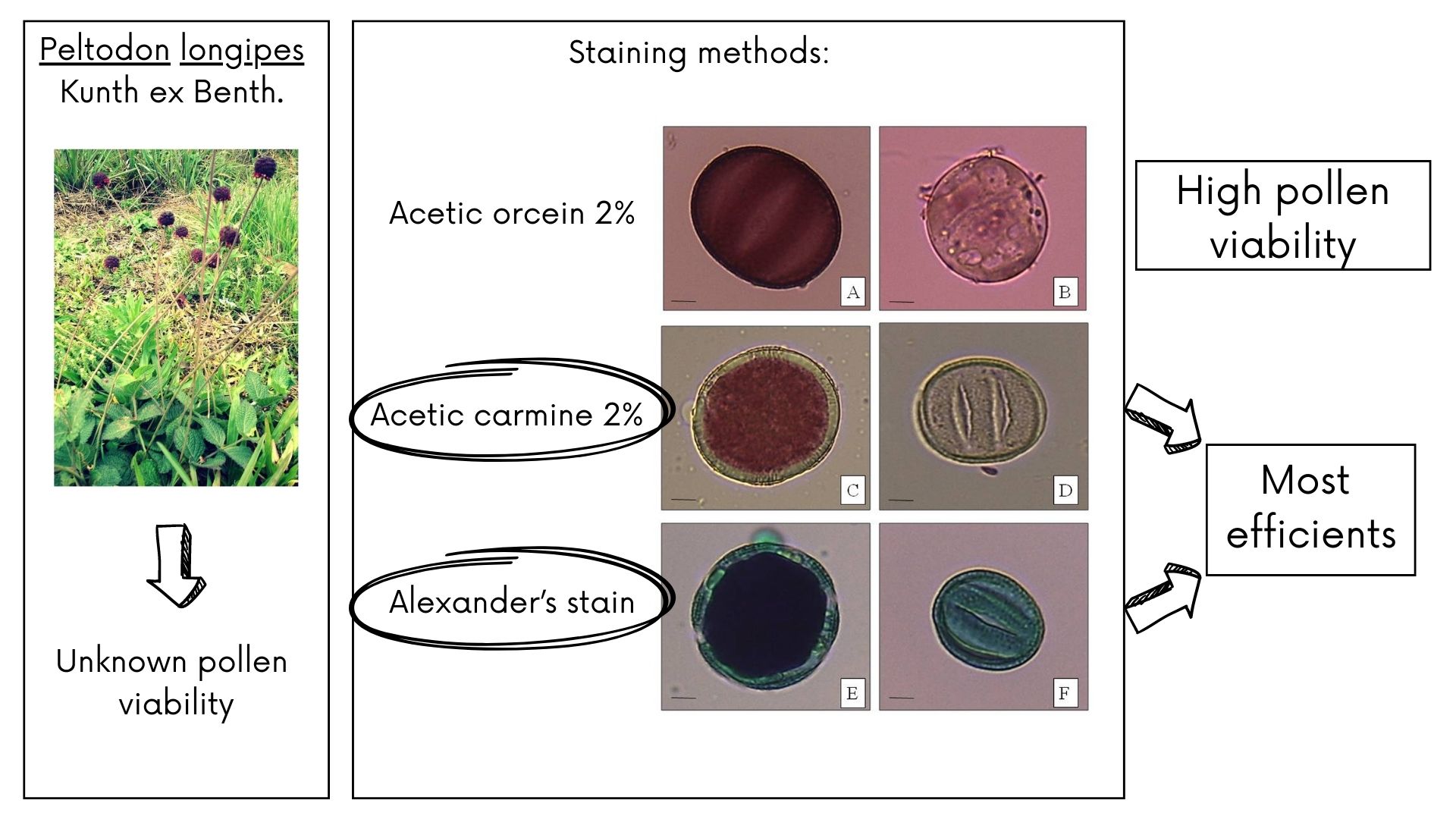
The pollen viability reveals the masculine breeding potential in plant species, and can be useful for taxonomic, ecological, genetic and palynological studies. In order to provide information on the medicinal species Peltodon longipes Kunth ex Benth., this study aimed at estimating the pollen viability in accessions of this species collected in the state of Rio Grande do Sul, by using three staining methods, as well as determining the most efficient stain. The inflorescences of 15 accessions were collected and fixed in ethanol/acetic acid (3:1 v/v) for 24 h and, subsequently, placed in 70% (v/v) ethanol under refrigeration until preparation of slides by the squashing technique. Three staining methods were used: acetic orcein 2%, acetic carmine 2%, and Alexander’s stain. Pollen grains stained with acetic orcein 2% with intense coloring were considered viable, while those of weak coloring were considered non-viable. The grains treated with acetic carmine 2% were considered viable when they were stained red, whereas the transparent ones and those showing no staining were considered non-viable. The pollen grains stained with Alexander’s stain were viable when the pollen was purple and non-viable when it was light blue-green. A completely randomized design was used and the data collected was submitted to analysis of variance (ANOVA) and compared by the Scott-Knott test at 5% probability of error. Of the 15 accessions of P. longipes, 13 showed high pollen viability, with values above 75% and the methods using acetic carmine 2% and Alexander reactive, were the most efficient technique for this species.
Downloads
References
Alexander MPA (1980) Versatile stain for pollen fungi, yeast and bacterium. Stain Technol 5(1): 13-18.
https://doi.org/10.3109/10520298009067890
Almeida OS, Silva AHB, Silva AB, Silva AB, Amaral CLF (2004) Estudo da biologia floral e mecanismos reprodutivos do alfavacão (Ocimum officinalis L.) visando o melhoramento genético. Acta Sci Biol Sci 26(3): 343-348.
https://doi.org/10.4025/actascibiolsci.v26i3.1598
Almeida OS, Ribeiro GS, Alves JS, Silva AB, Rebouças TNH, Amaral CLF (2006) Estimativa da viabilidade polínica em espécies do gênero Ocimum com diferentes corantes. In: 46º Congresso Brasileiro de Olericultura, Goiânia. Anais... Horticultura Brasileira. Brasília: ABH, 24: 242-242.
Arnous AH, Santos AS, Beinner RPC (2005) Plantas medicinais de uso caseiro - conhecimento popular e interesse por cultivo comunitário. Revista Espaço para a Saúde 6(2): 1-6.
Auler NMF, Battistin A, Reis MS (2006) Número de cromossomos, microsporogênese e viabilidade do pólen em populações de carqueja [Baccharis trimera (Less) DC.] do Rio Grande do Sul e Santa Catarina. Rev Bras Plantas Med 8: 55-63.
Coelho APD, Morais KP, Laughinghouse IV HD, Giacomini SJ, Tedesco SB (2012) Pollen grain viability in accessions of Crotalaria juncea l. (Fabaceae). Agrociencia 46: 481-487.
Danner MA, Citadin I, Sasso SAZ, Sachet MR, Malagi G (2011) Modo de reprodução e viabilidade de pólen de três espécies de jabuticabeira. Rev Bras Frutic 33(2): 345-352.
https://doi.org/10.1590/S0100-29452011005000077
Facanali R (2008) Estudo da biologia reprodutiva, diversidade genética e química de populações de Ocimum selloi Benth. 145 f. Tese (Doutotrado em Agronomia - Horticultura) - Universidade Estadual Paulista “Júlio de Mesquita Filho” Faculdade de Ciências Agronômicas da UNESP - Câmpus de Botucatu, São Paulo.
Fereira CA, Von Pinho EVR, Alvim PO, Andrade V, Silva TTA, Cardoso DL (2007) Conservação e determinação da viabilidade de grão de pólen de milho. Rev Bras Milho Sorgo 6: 159-173.
https://doi.org/10.18512/1980-6477/rbms.v6n02p%25p
Feijó AM, Bueno MEN, Ceolin T, Lonck CL, Schwarts E, Lange C, Meincke SMK, Heck RM, Barbieri RL, Heiden G (2012) Plantas medicinais utilizadas por idosos com diagnóstico de Diabetes mellitus no tratamento dos sintomas da doença. Rev Bras Plantas Med 14(1): 50-56.
https://doi.org/10.1590/S1516-05722012000100008
Frescura VD, Laughinghouse IV HD, Canto-Dorow TS, Tedesco SB (2012) Pollen viability of Polygala paniculata L. (Polygalaceae) using different staining methods. Biocell 36(3): 143-145.
Fronza M, Murilo R, Slusarczyk S, Adams M, Hamburger M, Heinzmann B, Laufer S, Merfort I (2011) In vitro cytotoxic activity of abietane diterpenes from Peltodon longipes as well as Salvia miltiorrhiza and Salvia sahendica. Bioorg Med Chem 19: 4876–4881.
https://doi.org/10.1016/j.bmc.2011.06.067
Guerra M, Souza MJ (2002) Como observar cromossomos – Um guia de técnicas em citogenética vegetal, animal e humana. Ribeirão Preto: FUNPEC. 131p.
Martins ER, Castro DM, Castellani DC, Dias JE (1994) Plantas Medicinais, Universidade Federal de Viçosa, Viçosa, Minas Gerais. 220p.
Martins KC (2010) Palinologia de Capsicum spp.: caracterização, divergência e viabilidade polínica. Rio de Janeiro, RJ. Dissertação (mestrado em Genética e Melhoramento de Plantas) - Centro de Ciências e Tecnologias Agropecuárias, Universidade Estadual do Norte Fluminense Darcy Ribeiro, Campos dos Goytacazes.
Moraes PLR, Derbyshire MTVC (2002) Estrutura genética de populações naturais de Cryptocarya aschersoniana Mez (Lauraceae) através de marcadores isoenzimáticos. Biota Neotropica, 2(2): 1-19.
https://doi.org/10.1590/S1676-06032002000200011
Mori SA, Silva LAM, Lisboa G, Coradin L (1989) Manual de Manejo de Herbário Fanerogâmico. Bahia: Centro de Pesquisas do Cacau, ed. 104p.
Mors WB, Rizzini CT, Pereira NA, Defilipps RA (2000) Medicinal Plantas of Brazil. Reference Publications, Inc., Algonac, Michigan. 501p.
Munhoz M, Luz CFP, Meissner Filho PE, Barth OM, Reinert F (2008) Viabilidade polínica de Caryca papaya L.: Uma comparação metodológica. Rev Bras Bot 31(2): 209-214.
http://dx.doi.org/10.1590/S0100-84042008000200003
Neto ODS, Karsburg IV, Yoshitome MY (2006) Viabilidade e germinabilidade polínica de populações de jurubeba (Solanum paniculatum L.). Rev Ciên Agro-Amb 4(1): 67-74.
Pagliarini MS, Pozzobon MT (2005) Meiose em vegetais: Um enfoque para a caracterização de germoplasma. In: II Curso de citogenética aplicada a recursos genéticos vegetais, 1., Brasília. Brasília: Embrapa Recursos Genéticos e Biotecnologia, p. 24-41.
Paula JM (2009) Caracterização e manejo de Conyza spp. resistente ao herbicida glifosato. 91 f. Dissertação (mestrado - Curso de Pós-Graduação em Fitossanidade), Universidade Federal de Pelotas, Pelotas.
Piccinini F, Frescura VDS, Laughinghouse IV HD, Perez NB, Tedesco SB (2012) Pollen viability of Eragrostis plana genotypes from different geographic populations in Rio Grande do Sul. Enc Biosfera 8(15): 13-16.
Pio LA, Ramos JD, Pasqual M, Junqueira KP, Santos FC, Rufini JCM (2007) Viabilidade do pólen de laranjas doces em diferentes condições de armazenamento. Ciên Agrotec 31: 147-153.
https://doi.org/10.1590/S1413-70542007000100022
Souza MM, Pereira TNS, Martins ER (2002) Microsporogênese e microgametogênese associadas ao tamanho do botão floral e da antera e viabilidade polínica em maracujazeiro-amarelo (Passiflora edulis Sims f. Flavicarpa degener). Ciên Agrotéc 26(6): 1209-1217.
Vargas DP (2006) Mamona (Ricinus communis L.): cultura de antera, viabilidade e conservação de pólen. 98 f. Dissertação (mestrado em Ciências), Universidade Federal de Pelotas, Pelotas.
Downloads
Published
Issue
Section
License

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.

